நூலாசிரியர்:
Lewis Jackson
உருவாக்கிய தேதி:
5 மே 2021
புதுப்பிப்பு தேதி:
1 ஜூலை 2024

உள்ளடக்கம்
மோல் என்பது வேதியியலில் அளவீட்டுக்கான நிலையான அலகு ஆகும், இது ஒரு சேர்மத்தில் உள்ள வெவ்வேறு கூறுகளைப் பார்க்கப் பயன்படுகிறது. வழக்கமாக கூட்டு வெகுஜன கிராம் (கிராம்) இல் கணக்கிடப்படுகிறது மற்றும் மோலார் அலகுகளாக மாற்றப்பட வேண்டும். மாற்றம் மிகவும் எளிதானது, இருப்பினும், நாம் பின்பற்ற வேண்டிய சில முக்கியமான படிகள் இன்னும் உள்ளன. கீழே உள்ள முறையைப் பயன்படுத்தி, நீங்கள் எளிதாக கிராம் மோல்களாக மாற்றலாம்.
படிகள்
2 இன் பகுதி 1: மூலக்கூறு வெகுஜனத்தைக் கணக்கிடுங்கள்
கணித சிக்கலை தீர்க்க தேவையான பொருட்களை தயார் செய்யுங்கள். உங்களிடம் எல்லா கருவிகளும் இருக்கும்போது, சிக்கலைத் தீர்ப்பது எளிதாக இருக்கும். உங்களுக்கு தேவையானது:
- பென்சில் மற்றும் காகிதம். நீங்கள் எல்லாவற்றையும் காகிதத்தில் எழுதும்போது கணிதம் எளிதாகிறது. அதிகபட்ச மதிப்பெண்ணை அடைய நீங்கள் அனைத்து படிகளையும் முன்வைக்க வேண்டும்.
- இரசாயன கூறுகளின் கால அட்டவணை: தனிமங்களின் வெகுஜன அணுக்களை தீர்மானிக்கப் பயன்படுகிறது.
- பாக்கெட் கால்குலேட்டர்: சிக்கலான எண்களைக் கணக்கிடப் பயன்படுகிறது.

நீங்கள் மோலார் அலகுகளாக மாற்ற வேண்டிய கலவையில் எந்த கூறுகள் உள்ளன என்பதைத் தீர்மானிக்கவும். மூலக்கூறு வெகுஜனத்தைக் கணக்கிடுவதற்கான முதல் படி, கலவையை உருவாக்கும் உறுப்புகளைத் தீர்மானிப்பதாகும். உறுப்புகளின் சுருக்கம் ஒன்று முதல் இரண்டு எழுத்துக்கள் மட்டுமே என்பதால் இது எளிதானது.- ஒரு பொருள் இரண்டு எழுத்துக்களுடன் சுருக்கமாக இருந்தால், முதல் எழுத்து பெரியதாக்கப்பட்டு இரண்டாவது எழுத்து சிறிய எழுத்து ஆகும். எடுத்துக்காட்டு: Mg என்பது மெக்னீசியம் என்ற உறுப்புக்கான சுருக்கமாகும்.
- NaHCO கலவைகள்3 சோடியம் (நா), ஹைட்ரஜன் (எச்), கார்பன் (சி) மற்றும் ஆக்ஸிஜன் (ஓ) ஆகிய நான்கு கூறுகளைக் கொண்டுள்ளது.
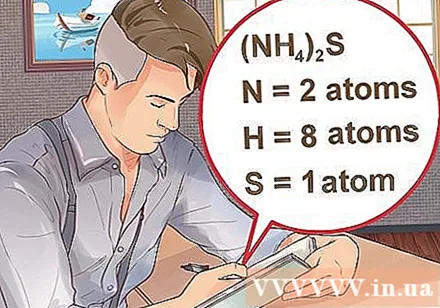
கலவையில் உள்ள ஒவ்வொரு உறுப்புக்கும் அணுக்களின் எண்ணிக்கையை தீர்மானிக்கவும். அந்த சேர்மத்தின் வெகுஜன மூலக்கூறைக் கணக்கிட ஒரு சேர்மத்தில் உள்ள ஒவ்வொரு பொருளின் அணு எண்ணையும் நீங்கள் அறிந்து கொள்ள வேண்டும். தனிமத்தின் சுருக்கத்திற்கு அடுத்த சிறிய எண் தனிமத்தின் அணு எண்ணைக் குறிக்கிறது.- எடுத்துக்காட்டு: கலவை எச்2O க்கு இரண்டு ஹைட்ரஜன் அணுக்களும் ஒரு ஆக்ஸிஜன் அணுவும் உள்ளன.
- ஒரு சிறிய குறியீட்டுடன் சேர்ந்து அடைப்புக்குறிக்குள் ஒரு கலவை எழுதப்பட்டால், அதாவது அடைப்புக்குறிக்குள் உள்ள ஒவ்வொரு மூலப்பொருளும் குறியீட்டைப் பெருக்கும். எடுத்துக்காட்டு: கலவை (என்.எச்4)2எஸ் இரண்டு N அணுக்கள், எட்டு எச் அணுக்கள் மற்றும் ஒரு எஸ் அணுவைக் கொண்டுள்ளது.

ஒவ்வொரு உறுப்புக்கும் கன அணு காகிதத்தை எழுதுங்கள். கால அட்டவணையைப் பயன்படுத்துவது ஒரு தனிமத்தின் கன அணுவைக் கண்டுபிடிப்பதற்கான எளிதான வழியாகும். கால அட்டவணையில் நீங்கள் உறுப்பைக் கண்டறிந்த பிறகு, உறுப்பு ஐகானுக்குக் கீழே அணு வெகுஜனத்தைக் காண்பீர்கள்.- உதாரணமாக, ஆக்ஸிஜனின் கன அணு 15.99 ஆகும்.
மூலக்கூறு வெகுஜனத்தைக் கணக்கிடுங்கள். ஒரு பொருளின் வெகுஜன மூலக்கூறு ஒவ்வொரு தனிமத்தின் அணுக்களின் எண்ணிக்கையுடன் சமமாக இருக்கும், அந்த உறுப்பின் வெகுஜன அணுவால் பெருக்கப்படுகிறது. இந்த அளவு கிராம் முதல் மோலார் மாற்றத்திற்கு அவசியம்.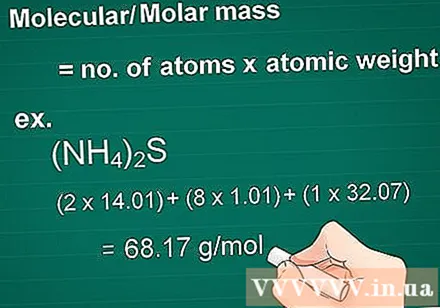
- முதலில், கலவையின் ஒவ்வொரு தனிமத்தின் அணு எண்ணையும் அதன் வெகுஜன அணுவால் பெருக்கவும்.
- பின்னர் சேர்மத்தில் உள்ள தனிமங்களின் வெகுஜனங்களை ஒன்றாகச் சேர்க்கவும்.
- எடுத்துக்காட்டு: ஒரு சேர்மத்தின் மூலக்கூறு நிறை (NH4)2எஸ் = (2 x 14.01) + (8 x 1.01) + (1 x 32.07) = 68.17 கிராம் / மோல்.
- மூலக்கூறு நிறை மோலார் மாஸ் என்றும் அழைக்கப்படுகிறது.
பகுதி 2 இன் 2: கிராம் மோலுக்கு மாற்றவும்
மாற்று சூத்திரத்தை அமைக்கவும். சேர்மத்தின் மோல்களின் எண்ணிக்கையைக் கண்டுபிடிக்க, அந்த சேர்மத்தின் மோலார் வெகுஜனத்தால் கலவையின் கிராம் எண்ணிக்கையைப் பிரிக்கவும்.
- சூத்திரம்: மோல்களின் எண்ணிக்கை = நிறை (கிராம்) / மோலார் நிறை கலவை (கிராம் / மோல்)
எண்களை சூத்திரத்தில் மாற்றவும். சரியான சூத்திரத்தை அமைத்த பிறகு, அடுத்த கட்டமாக நீங்கள் கணக்கிட்ட எண்களை சூத்திரத்துடன் மாற்ற வேண்டும். தரவு சரியான நிலையில் உள்ளதா என்பதை உறுதிப்படுத்த விரும்பினால், அலகு அடக்குவதன் மூலம் அதைச் சரிபார்க்கலாம். எளிமைக்குப் பிறகு மீதமுள்ள அலகு மோல் என்றால் நீங்கள் சரியாக அமைக்கப்படுவீர்கள்.
சமன்பாட்டை தீர்க்கவும். ஒரு கால்குலேட்டரைப் பயன்படுத்தி, பொருளின் அல்லது கலவையின் கன மூலக்கூறு மூலம் வெகுஜனத்தைப் பிரிக்கவும். மேற்கோள் நீங்கள் தேடும் பொருள் அல்லது கலவையின் மோல்களின் எண்ணிக்கையாக இருக்கும்.
- உதாரணமாக, பிரச்சனை 2 கிராம் தண்ணீருக்கு (எச்2ஓ) மற்றும் அதை மோலார் அலகுகளாக மாற்றச் சொல்லுங்கள். எச் இன் மோலார் நிறை எங்களிடம் உள்ளது2O என்பது 18g / mol ஆகும். 2 ஐ 18 ஆல் வகுக்கவும், எனவே உங்களிடம் 0.1111 mol H2O உள்ளது.
ஆலோசனை
- உறுப்பு அல்லது கலவை பெயரை பதில்களுடன் சேர்க்க மறக்காதீர்கள்.
- ஒரு உடற்பயிற்சி அல்லது வினாடி வினாவை முன்வைக்கும்படி உங்களிடம் கேட்கப்பட்டால், பதில்களைச் சுற்றி ஒரு பெட்டியை வட்டமிடுவதன் மூலம் அல்லது வரைவதன் மூலம் உங்கள் பதில்களை தெளிவாகக் காட்ட மறக்காதீர்கள்.
உங்களுக்கு என்ன தேவை
- வேதியியல் கால அட்டவணை
- எழுதுகோல்
- காகிதம்
- கணினி
- வேதியியல் சிக்கல்கள்