நூலாசிரியர்:
Louise Ward
உருவாக்கிய தேதி:
11 பிப்ரவரி 2021
புதுப்பிப்பு தேதி:
1 ஜூலை 2024

உள்ளடக்கம்
ஒரு அணுவின் அளவு மிகவும் சிறியது, ஒரு வேதியியல் சேர்மத்தின் அணு எண்ணிக்கையை துல்லியமாக அளவிடுவது கடினம். பொருட்களின் அளவை துல்லியமாக அளவிட, விஞ்ஞானிகள் ஒரு குறிப்பிட்ட எண்ணிக்கையிலான அணுக்களைக் குறிக்க ஒரு அலகு மோலைப் பயன்படுத்துகின்றனர். ஒரு கார்பன் ஐசோடோப்பின் 12 கிராம் உள்ள கார்பன் அணுக்களின் எண்ணிக்கைக்கு சமமான ஒரு மோல் பொருள் வரையறுக்கப்படுகிறது, இது சுமார் 6,022 x 10 அணுக்கள். இந்த மதிப்பு அவகாட்ரோ எண் அல்லது அவகாட்ரோ மாறிலி என்று அழைக்கப்படுகிறது. இது எந்தவொரு தனிமத்தின் 1 மோலில் உள்ள அணுக்களின் எண்ணிக்கை என்றும் குறிப்பிடப்படுகிறது, மேலும் ஒரு பொருளின் வெகுஜனத்தின் 1 மோல் அந்த பொருளின் மோலார் நிறை என்று அழைக்கப்படுகிறது.
படிகள்
2 இன் முறை 1: ஒரு தனிமத்தின் மோலார் வெகுஜனத்தைக் கணக்கிடுங்கள்
மோலார் வெகுஜனத்தின் வரையறை. ஒரு பொருளின் மோலார் வெகுஜனமானது அந்த பொருளின் ஒரு மோலின் நிறை (கிராம்) ஆகும். ஒரு தனிமத்தின் மோலார் வெகுஜனத்தைக் கணக்கிட, அதன் அணு வெகுஜனத்தை கிராம்-பெர்-மோல் மாற்று காரணி (கிராம் / மோல்) மூலம் பெருக்கவும்.
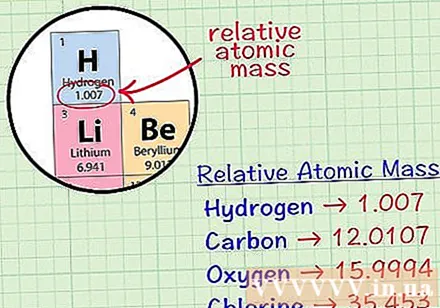
ஒரு தனிமத்தின் சராசரி கன அணுவைக் கண்டறியவும். ஒரு தனிமத்தின் சராசரி வெகுஜன அணு என்பது அணு அலகுகளில், அந்த தனிமத்தின் அனைத்து ஐசோடோப்புகளையும் உள்ளடக்கிய ஒரு மாதிரியில் சராசரி நிறை ஆகும். இந்த தகவல் பெரும்பாலும் உறுப்புகளின் கால அட்டவணையில் கொடுக்கப்படுகிறது. ஒரு உறுப்பைக் கண்டுபிடிப்பதன் மூலம், உறுப்பின் வேதியியல் சின்னத்திற்கு கீழே எழுதப்பட்ட சராசரி கன அணுவைக் காணலாம். இந்த மதிப்பு ஒரு முழு எண் அல்ல, ஆனால் தசம இடங்களைக் கொண்ட எண்.- எடுத்துக்காட்டாக, ஹைட்ரஜனுடன், சராசரி வெகுஜன அணு 1.007; கார்பனின் சராசரி கன அணு 12,0107; ஆக்ஸிஜனின் சராசரி வெகுஜன அணு 15,9994; குளோரின் சராசரி அணு நிறை 35,453 ஆகும்.

சராசரி வெகுஜன அணுவை மோலார் வெகுஜன மாறிலியால் பெருக்கவும். மோலார் கிளைட்டின் அலகு ஒரு மோலுக்கு 0.001 கிலோகிராம் அல்லது ஒரு மோலுக்கு 1 கிராம் என வரையறுக்கப்படுகிறது. சராசரி வெகுஜன அணுவின் தயாரிப்பு மற்றும் மோலார் வெகுஜன மாறிலி அணு வெகுஜனத்தின் அலகு ஒரு மோலுக்கு கிராம் ஆக மாற்றுகிறது, எனவே ஹைட்ரஜனின் மோலார் நிறை ஒரு மோலுக்கு 1.007 கிராம் ஆக இருக்கும், கார்பனுக்கு இது 12 ஆகும். , ஒரு மோலுக்கு 0107 கிராம், ஆக்ஸிஜன் ஒரு மோலுக்கு 15,9995 கிராம், மற்றும் குளோரின் ஒரு மோலுக்கு 35,453 கிராம்.- இரண்டு அல்லது அதற்கு மேற்பட்ட ஒரே அணுக்களைக் கொண்ட மூலக்கூறுகளாக சில கூறுகள் இயற்கையில் உள்ளன. அதாவது, ஹைட்ரஜன் வாயு, ஆக்ஸிஜன் வாயு அல்லது குளோரின் வாயு போன்ற ஒன்றுக்கு மேற்பட்ட அணுக்களால் ஆன சேர்மங்களின் மோலார் வெகுஜனத்தை நீங்கள் கணக்கிட விரும்பினால், நீங்கள் கலவையின் சராசரி அணு வெகுஜனத்தை தீர்மானித்து இந்த மதிப்பை பெருக்க வேண்டும். மோலார் வெகுஜன மாறிலியுடன், '' பின்னர் '' நீங்கள் இப்போது கண்டறிந்த தயாரிப்பை 2 ஆல் பெருக்கவும்.
- எச் உடன்2: ஒரு மோலுக்கு 1,007 x 2 = 2,014 கிராம்; O க்கு2: ஒரு மோலுக்கு 15,9994 x 2 = 31,9988 கிராம்; மற்றும் Cl2: ஒரு மோலுக்கு 35,453 x 2 = 70,096 கிராம்.
2 இன் முறை 2: சேர்மத்தின் மோலார் வெகுஜனத்தைக் கணக்கிடுங்கள்

கலவையின் கட்டமைப்பு சூத்திரத்தை தீர்மானிக்கவும். ஒரு பொருளின் கட்டமைப்பு சூத்திரம் அந்த சேர்மத்தை உருவாக்கும் ஒவ்வொரு தனிமத்தின் அணு எண்ணையும் தருகிறது. (இந்த தகவல் அனைத்து குறிப்பு புத்தகங்களிலும் கிடைக்கிறது). எடுத்துக்காட்டாக, ஹைட்ரோகுளோரிக் அமிலத்தின் வேதியியல் சூத்திரம் எச்.சி.எல்; குளுக்கோஸின் சி6எச்12ஓ6. இந்த கட்டமைப்பு சூத்திரத்தின் மூலம், பரிசீலிக்கப்படும் கலவையை உருவாக்கும் ஒவ்வொரு வகை அணுவின் எண்ணிக்கையையும் நாம் தீர்மானிக்க முடியும்.- எச்.சி.எல் ஒரு ஹைட்ரஜன் அணுவையும் ஒரு குளோரின் அணுவையும் கொண்டுள்ளது.
- குளுக்கோஸ் சர்க்கரை மூலக்கூறு சி6எச்12ஓ6 6 கார்பன் அணுக்கள், 12 ஹைட்ரஜன் அணுக்கள் மற்றும் 6 ஆக்ஸிஜன் அணுக்கள் உள்ளன.
ஒவ்வொரு தொகுதி உறுப்புகளின் சராசரி வெகுஜன அணுவை தீர்மானிக்கவும். கலவையில் இருக்கும் ஒவ்வொரு தனிமத்தின் சராசரி வெகுஜன அணுவைக் கண்டுபிடிக்க கால அட்டவணையைப் பயன்படுத்தவும். சராசரி வெகுஜன அணு பொதுவாக கால அட்டவணையில் உள்ள உறுப்பு வேதியியல் குறியீட்டின் கீழ் எழுதப்படுகிறது. ஒரு தனிமத்தின் மோலார் வெகுஜனத்தைக் கணக்கிடுவதைப் போலவே, சராசரி வெகுஜன அணுவை 1 கிராம் / மோல் மூலம் பெருக்கவும்.
- ஹைட்ரோகுளோரிக் அமிலத்தை உருவாக்கும் உறுப்புகளின் சராசரி வெகுஜன அணு பின்வருமாறு: ஹைட்ரஜன் 1,007 கிராம் / மோல் மற்றும் குளோரின் 35,453 கிராம் / மோல்.
- குளுக்கோஸ் மூலக்கூறு உருவாக்கும் உறுப்புகளின் சராசரி வெகுஜன அணு: கார்பன், 12,017 கிராம் / மோல்; ஹைட்ரஜன், 1,007 கிராம் / மோல்; மற்றும் ஆக்ஸிஜன், 15,995 கிராம் / மோல்.
ஒவ்வொரு கூறு உறுப்புகளின் மோலார் வெகுஜனத்தைக் கணக்கிடுங்கள். ஒரு தனிமத்தின் வெகுஜன அணுவை ஒரு சேர்மத்தில் பங்களிக்கும் அணுக்களின் எண்ணிக்கையால் பெருக்கினால், சேர்மத்தில் உள்ள தனிமத்தின் சராசரி வெகுஜனத்தை அளிக்கிறது.
- ஹைட்ரோகுளோரிக் அமிலம், எச்.சி.எல் விஷயத்தில், ஹைட்ரஜன் தனிமத்தின் மோலார் நிறை 1,007 கிராம் / மோல், மற்றும் குளோரின் 35,453 கிராம் / மோல் ஆகும்.
- குளுக்கோஸ் விஷயத்தில், சி6எச்12ஓ6, ஒவ்வொரு தனிமத்தின் மோலார் நிறை பின்வருமாறு: கார்பன், 12,0107 x 6 = 72,0642 கிராம் / மோல்; ஹைட்ரஜன், 1,007 x 12 = 12,084 கிராம் / மோல்; ஆக்ஸிஜன், 15,9995 x 6 = 95,9964 கிராம் / மோல்.
தொகுதி உறுப்புகளின் மொத்த மோலார் நிறை. உரம் கூறுகளின் மொத்த மோலார் நிறை என்பது கலவையின் மோலார் நிறை.முந்தைய கட்டத்தில், கலவையில் இருக்கும் ஒவ்வொரு தனிமத்தின் மோலார் வெகுஜனத்தையும் கணக்கிட்டோம், இந்த கட்டத்தில் இந்த மதிப்புகள் அனைத்தையும் ஒன்றாக சேர்க்க வேண்டும்.
- ஹைட்ரோகுளோரிக் அமிலத்தின் மோலார் நிறை 1,007 + 35,453 = 36,460 கிராம் / மோல் ஆகும். 36.46 கிராம் என்பது ஹைட்ரோகுளோரிக் அமிலத்தின் 1 மோல் ஆகும்.
- குளுக்கோஸின் மோலார் நிறை 72,0642 + 12,084 + 95,9964 = 180,1446 கிராம் / மோல் ஆகும். எனவே குளுக்கோஸின் ஒவ்வொரு மோல் 180.14 கிராம் நிறை கொண்டது.
ஆலோசனை
- பெரும்பாலான சந்தர்ப்பங்களில், சராசரி வெகுஜன அணு அருகிலுள்ள 1 பகுதி 1000 (4 தசம இடங்கள்) இல் பதிவு செய்யப்பட்டாலும், ஆய்வகங்களில், மோலார் நிறை பெரும்பாலும் 2 தசம இடங்களாகக் குறைக்கப்படுகிறது, பெரிய மூலக்கூறுகளுக்கு சில நேரங்களில் கூட குறைவாக இருக்கும். ஆகையால், ஆய்வக வழக்கில், ஹைட்ரோகுளோரிக் அமிலத்தின் மோலார் நிறை ஒரு மோலுக்கு 36.46 கிராம் என எழுதப்படலாம், ஒரு மோலுக்கு குளுக்கோஸ் 180.14 கிராம்.
உங்களுக்கு என்ன தேவை
- வேதியியல் குறிப்பு புத்தகம் அல்லது உறுப்புகளின் கால அட்டவணை
- கணினி